【新冠病毒機制】袁國勇團隊發現新冠病毒入侵細胞途徑 解開肺部受損之謎有助研新治療策略
醫學界目前認為新冠病毒是透過ACE2受體入侵細胞,惟肺部ACE2受體水平相對較低。港大微生物學系教授袁國勇團隊發現另外兩種入侵機制,其中Sheddase酶令ACE2受體變為可溶性,到達肺部任何區域,團隊表示是次發現有助研定新治療策略。
 Photo from 港大微生物學系
Photo from 港大微生物學系
港大微生物學系教授袁國勇表示,過去普遍認為新冠狀病毒只能夠感染或進入一些能在其細胞表面產生受體(稱為ACE2)的細胞,但與腎臟,腸,血管,卵巢和睾丸相比,大多數肺細胞表達這種受體ACE2的水平相對地很低,故這種入侵機制未能解釋為何肺部是新冠病毒感染最嚴重的器官。
研究人員進行功能缺失型的全基因組RNAi篩選,以鑑定宿主表達哪些對於新冠病毒複製必不可少的相關基因。通過對這些宿主因子的詳細分析,團隊發現一種兩型病毒進入細胞的新途徑:
一、只要某些細胞具有Sheddase酶(去整合素-金屬蛋白酶17)釋放其細胞受體ACE2進入血液循環中。血液中的這些可溶性ACE2受體可以飄到到肺的任何位置。即使肺細胞不產生足夠細胞的ACE2受體,可溶性ACE2受體也可以與病毒表面的棘突蛋白(spike)結合,產生了這個可溶性ACE2-Spike 複合物(鏈接病毒), 複合物(與病毒)因而被細胞表面的血管緊張素1受體(AT1)捕獲,然後通過受體介導的內吞作用進入細胞並開始病毒複製。
二、病毒表面的棘突蛋白(spike) 也可以結合血液中的一種稱為血管加壓素(vasopressin)的可溶性激素。產生了這個Spike-可溶性ACE2-vasopressin 複合物(鏈接病毒),這個複合物被在細胞表面的精氨酸血管加壓素受體1b(AVPR1B)捕獲,因此病毒可以通過受體介導的內吞作用進入細胞複製病毒。
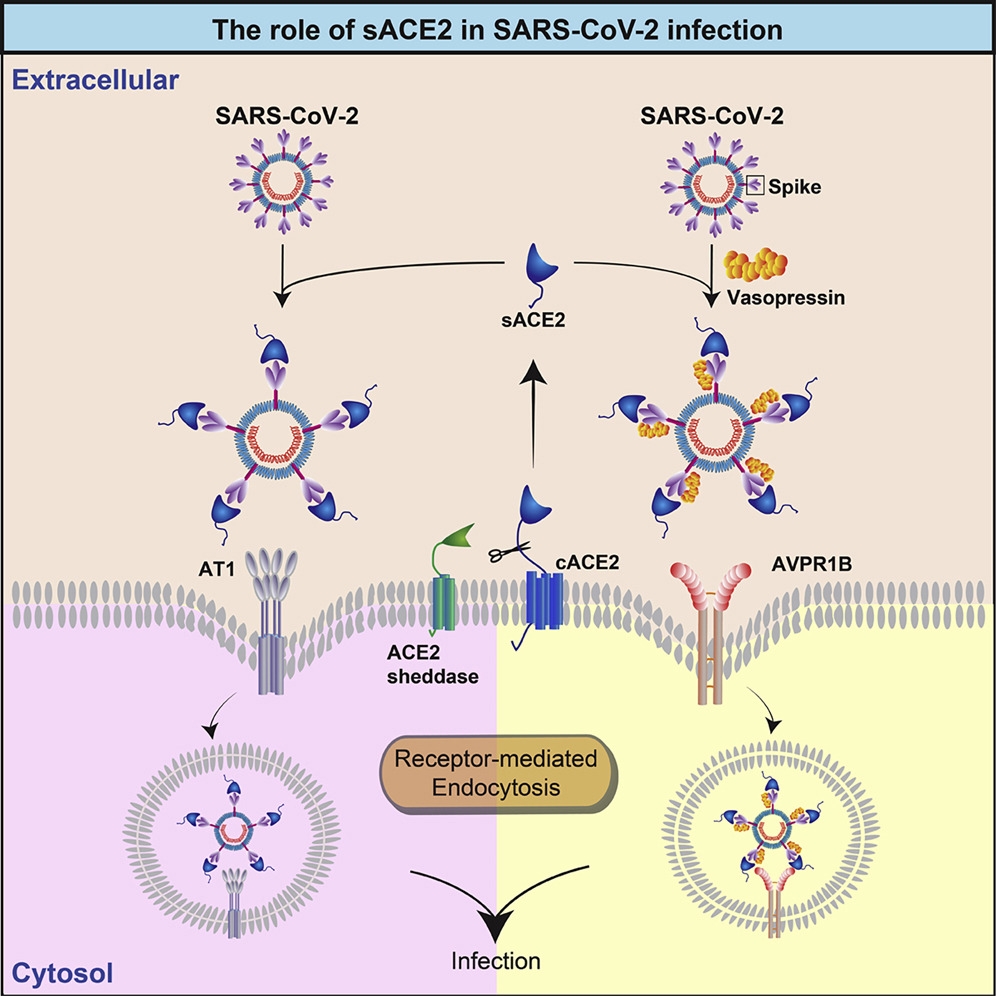 Photo from 《Cell》
Photo from 《Cell》
袁國勇形容研究是一個開創性的發現,現時已經有化合物可以抑制可溶性ACE2的釋放酶(Sheddase酶,去整合素-金屬蛋白酶17),從而減少並阻止病毒複製,還有一些化合物可以抑制AT1,AVPR1B的受體功能和細胞內運輸,相信是次研究能為開發新的治療病毒藥物提供機理和途徑。
Text : UrbanLife Health Editorial
Photos : UrbanLife Health Editorial、港大微生物學系
Source:港大微生物學系、《Cell》